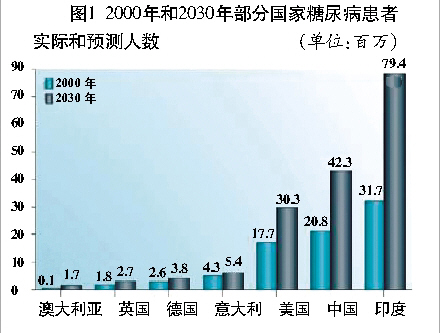
浅析治疗糖尿病药物市场 糖尿病发病率仍在逐年增加。根据世界卫生组织(WHO)提供的数据,发达国家糖尿病患病率已高达5%~10%,在我国则为3%左右;到2030年,全世界糖尿病患者人数将比2000年翻一番(图1)。
分析家指出,在未来一段时间内,1型糖尿病发病率仍将保持相对平稳,但2型糖尿病患者人数则会稳步增长。在美国和欧洲,2型糖尿病患者人数目前约占所有糖尿病患者人数的90%,在亚洲则几乎达到100%。
值得注意的是,胰岛素抵抗与肥胖症密切相关,在2型糖尿病患者中,有60~70%同时患有肥胖症。此外,胰岛素抵抗还有可能引起其他许多疾病,包括动脉粥样硬化、冠心病、肾功能衰竭和多囊卵巢综合征等。虽然饮食控制和加强运动能够有效降低肥胖症和其他糖尿病并发症的风险,但患者的依从性却不高。正因如此,研究人员还必须开发有效的糖尿病治疗药物来满足广大患者的需求。
口服药占据半壁江山
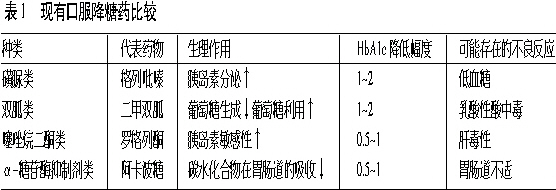
无论是在医药行业人士,还是在一般公众眼中,糖尿病无疑都是一种非常重要的疾病。2002年,美国糖尿病治疗总成本高达1320亿美元,而口服降糖药2001年的总销售额则超过82亿美元。(见表1)。
格华止(二甲双胍,百时美施贵宝)属于双胍类降糖药,可通过多种机制调节血糖,可有效降低患者空腹血糖和胰岛素水平,有助于改善患者脂质状况,并能轻度降低患者体重。由于疗效确定,且能与大多数其他口服降糖药合用,格华止在市场上取得了很大的成功。在2001年(专利期满前一年),格华止年销售额达到创纪录的27亿美元,处方量超过口服降糖药总处方量的三分之一,成为当时口服降糖药中的首选药物。不过,随着二甲双胍通用名药的大量涌现,格华止的销售额已经明显下降。
1997年,由于Warner-Lambert和三共公司研制的Rezulin(曲格列酮,首个噻唑烷二酮类药物品种)的出现,口服降糖药市场又发生了新的变化。Rezulin上市后,其销售额即迅速增长。不过,后来Rezulin还是因存在严重肝毒性而被迫退出市场。
在Rezulin上市2年后,文迪雅(罗格列酮,葛兰素史克)和Actos(吡格列酮,礼来/武田)相继面市。从降低糖化血红蛋白(HbA1c)的能力方面看,曲格列酮、罗格列酮和吡格列酮相差并不大。不过,在不良反应方面,三者却有所区别,后两者最常见的不良反应分别为血脂升高和水肿。尽管美国食品药品管理局(FDA)要求服用吡格列酮和罗格列酮的患者应密切监测其肝酶变化情况,但到目前为止,尚无证据表明这两种药物会引起肝脏毒性反应。此外,还有部分学者担心噻唑烷二酮类药物可能会对心力衰竭患者产生不利影响。不过,总体而言,这类药物还是具有较佳的风险/效益比。
市面上的降糖药还不够好
然而,尽管市面上口服降糖药种类繁多,但迄今为止,还没有哪种药物能够凭一己之力将2型糖尿病患者的HbA1c水平长期保持在目标范围之内。即使是联合用药方案,其疗效也会在3~4年后逐渐降低。此外,体重增加是许多降糖药面临的一道难题,许多口服降糖药,如磺脲类、α-糖苷酶抑制剂类和噻唑烷二酮类药物甚至还会诱发患者体重增加,这对于大多数本身已经肥胖的2型糖尿病患者来说,确实是难以忍受的。在目前的情况下,如果患者用口服降糖药仍无法有效控制血糖水平,那他们就只能注射胰岛素了。由此可见,开发具有全新作用机制以及较佳风险/效益比的新型降糖药已经成为科学家们亟待解决的一项重要任务。
新药增添动荡几许
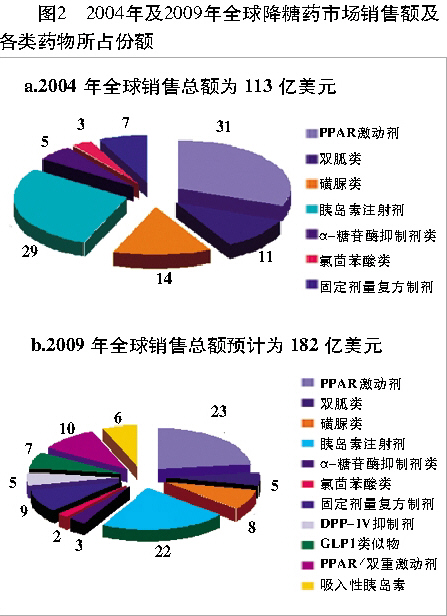
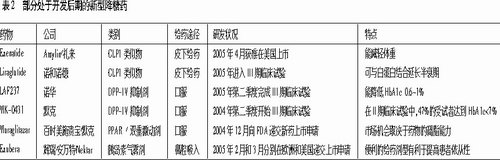
在未来几年中,许多具有全新作用机制和新剂型的降糖药将陆续登场,它们的出现不但为患者提供了更多的选择,而且也将促进降糖药市场的进一步发展(见图2、表2)。
目前,以刚刚上市的Exenatide为代表的胰升糖素样肽(GLP1)类似物正处于新型降糖药研发领域的前沿,紧随其后的是小分子二肽基肽酶Ⅳ(DPP-Ⅳ)和过氧化物酶体增殖活化受体/(PPAR/)双重激动剂。
有部分学者认为,从长远来看,能够口服的DPP-IV抑制剂和PPAR/双重激动剂也许会比需注射给药的GLP1类似物更有竞争优势。
GLP1类似物是目前值得关注的一类新型降糖药,将成为现有降糖药的一种补充治疗手段。GLP1是肠促胰岛素(又称肠降血糖素,是一种在餐后分泌、有助于控制血糖的激素)家族中的一员,它具有促进胰岛素分泌,抑制胰升糖素释放,抑制胃排空,增加β细胞数量等作用。研究发现,GLP1类似物能够降低患者体重,更平稳地控制血糖水平,不会产生低血糖。此外,GLP1类似物还能维持、甚至可能改善2型糖尿病患者的基础和葡萄糖刺激后的β细胞功能,延缓疾病进程。Ⅲ期临床试验结果显示,Amylin/礼来公司研制的GLP1类似物Byetta(Exenatide)能够安全、有效地控制口服降糖药治疗无效的2型糖尿病患者的血糖水平。今年4月,Byetta已获得FDA批准,预计在6月份正式上市。
DPP-Ⅳ抑制剂是另一类正在开发的新型降糖药,它能够通过抑制DPP-Ⅳ(负责降解GLP1的酶)的活性来维持体内GLP1水平。在临床试验中,诺华公司开发的DPP-Ⅳ抑制剂LAF237显示出良好的治疗效果,而且,此药似乎不会引起患者体重增加,其导致低血糖的风险也非常小。专家预测,LAF237的Ⅲ期临床试验结果将于今年下半年公布,其在美国的上市申请预计将于2006年递交。
2004年12月,百时美施贵宝和默克向FDA递交了新型降糖药BMS-298585 (Muraglitazar)的新药上市申请。Muraglitazar属于PPAR/双重激动剂。临床试验发现,PPAR/双重激动剂不但具有噻唑烷二酮类药物减少胰岛素抵抗的作用,而且还能象PPAR激动剂那样改善脂质代谢过程,包括降低甘油三酯水平,改善脂蛋白比例。因此,当PPAR/双重激动剂刚刚面世时,人们对此充满期待。不过,随后研究人员发现这类药物可能导致部分受试者肝功能异常,而且在临床前研究中还发现了这类药物的动物致癌性,由此,PPAR/双重激动剂的发展前景仍不明朗。
Acomplia(利莫那班)是赛诺菲-安万特公司研制的一种大麻素受体抑制剂,在Ⅲ期临床试验中,此药被用于治疗肥胖症、戒烟和酒精依赖性。如果有证据显示利莫那班能够通过减轻体重来延缓2型糖尿病的进程,那么此药未来的市场机会无疑要比单纯治疗肥胖症大得多。赛诺菲-安万特公司预计将于2005年向FDA递交利莫那班的上市申请,正式上市时间估计在2006年。
    (转载自《医药经济报》) |